首个申报上市新药一项全球Ⅲ期临床失败
《证券日报》记者了解到,4月28日,港股上市药企基石药业的合作伙伴Blueprint Medicines Corporation公布了在研药物avapritinib全球III期VOYAGER临床研究的主要研究结果。
结果显示,avapritinib虽然客观缓解率(ORR)优于对照组瑞戈非尼,但未能达到预期的主要终点,即avapritinib较瑞戈非尼未能改善局部进展、不可手术切除或转移性三线/四线晚期胃肠道间质瘤(GIST)患者的无进展生存期(PFS)。
据了解,这项研究是Blueprint Medicines Corporation在全球范围开展的临床研究,2019年12月10日,VOYAGER临床研究完成了中国患者的入组目标,因此上述研究结果包括了中国患者。
值得一提的是,港股上市药企基石药业于2018年6月4日与Blueprint Medicines Corporation达成独家合作和授权许可协议,开展包括avapritinib在内的三款药物的单药或联合治疗在中国大陆及香港、澳门和台湾地区的临床开发与商业化。
针对此事,《证券日报》记者向基石药业求证。公司在发给本报记者的《关于avapritinib全球临床研究结果的声明》中称,这意味着整体来说,avapritinib在疗效上和瑞戈非尼没有统计学差异。不过,目前GIST尚无四线的标准治疗。
一位不愿具名的业内人士向《证券日报》记者介绍,该事件并不影响avapritinib其他适应症的获批。“创新药研发本身就具有风险,失败也是常有的事情。”对基石药业的商业化之路不会产生太大影响。
据了解,avapritinib是一款KIT/PDGFRA抑制剂。2020年1月9日,美国FDA完全批准(fullapproval)该药上市,用于治疗PDGFRA外显子18突变(包括PDGFRAD842V突变)的不可切除或转移性GIST的成年患者。这是针对PDGFRAD842V突变的全球首款药物。
2020年4月23日,国家药监局受理了avapritinib两个适应症的新药上市申请,其中一个适应症为PDGFRA外显子18突变(包括PDGFRAD842V突变)的不可切除或转移性GIST,另一个适应症为进展、不可手术切除或转移性四线晚期GIST。这也是基石药业首个获国家药监局受理的新药上市申请,标志着公司向商业化转型迈出重要一步。
针对VOYAGER临床研究结果,基石药业表示,这不会影响AYVAKITTM(avapritinib)在美国的商业化,也不会影响到avapritinib在中国获得PDGFRA外显子18突变(包括PDGFRAD842V突变)的不可切除或转移性GIST适应症的审批。
基石药业称,公司还将继续开展avapritinib在其他适应症领域的研究,包括系统性肥大细胞增多症(SM)等。基于avapritinib优秀的临床前和临床研究结果显示,目前,基石药业正在中国大陆积极准备上市申请此两项适应症的递交路径。
受上述消息影响,港股上市药企基石药业5月6日股价调整,一度跌幅约9%。
标签: 首个申报上市新药
您可能也感兴趣:
今日热点
为您推荐
小康股份回应与华为关系及未来规划
“低首付”丰田金融服务让有车生活触手可及
万亿新赛道,未势能源A轮融资9亿,再掀起氢能投资热!
排行
精彩推送
- 斑马家政云完成8千万元A+轮融资,重新定义家政行业
- 蔚小理冲破魏建军的“长城”?
- 大厂为什么都想做“种草”?
- 福建矿业大佬凶猛
- 首发 | 「街景梦工厂」完成近亿元A+轮融资,这条6000亿赛道开始升温
- 看完这些过年大动作,我想回老家当土狗
- 北京城市副中心产业引导基金 子基金及子基金管理人投资筛选标准
- 网传盒马独立融资,生鲜的资本故事还丰满吗
- 网约车大战重启,乱象重出江湖
- 国产车企都在混什么?
- 春节档神仙打架,利好哪些上市公司
- 作业帮受邀出席稀土开发者大会 分享服务治理探索和落地实践
- 《梅艳芳》拯救香港影市
- 北京城市副中心产业引导基金设立,规模50亿元
- 28家企业完成融资,近百家资本涌入,医美上游谁是最强王者
- 快手春节活动分22亿红包,官方公布总冠方营销玩法
- 百货商场谋转型,“购物中心化”成趋势
- 《开端》开了个好头吗
- 作业帮推出智能硬件“小鹿写字笔”,黑科技提升孩子写字素养
- 当男生贴起面膜,VC赶来了
- “碳中和”成热点,拖鞋、玩具和汽车配件公司都要做光伏
- 祛魅元宇宙:一文看懂的投资逻辑和哲学思考
- 字节再变阵,「代理人」战争终结
- 快递价格战结束了吗
- 手握年轻人的B站,却握不住未来
- 辛巴们梦碎起步股份
- 微软买暴雪要弄元宇宙,任天堂不Care
- 砸下687亿美元,拥有COD的微软能挑战腾讯和索尼吗
- 动视暴雪为何价值687亿美元,元宇宙诸神之战开启
- 首发|儿童健康鲜食品牌「唯鲜良品」获峰瑞资本投资
- 字节裁撤投资业务,腾讯投资合伙人退出多家法人,蚂蚁减持众...
- B站的审核员不够用了
- 微软收购暴雪,等于张无忌学会太极拳
- 散户神坛变“祭坛”,Robinhood的危机才刚刚开始
- 红杉中国,一只罕见新基金诞生
- 过气韩束,能撑起上美IPO吗
- 贴身肉搏 午餐肉打响铁盒之战
- OKAI完成近亿元首轮融资,中金汇融基金领投
- 72小时筹集4000万美元,Web3.0到底是什么
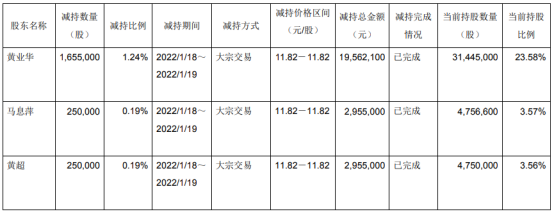
- 华菱精工3名股东合计减持215.5万股 价格区间为11.82-11.82元/股
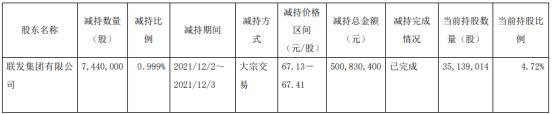
- 宏发股份股东联发集团减持744万股 价格区间为67.13-67.41元/股
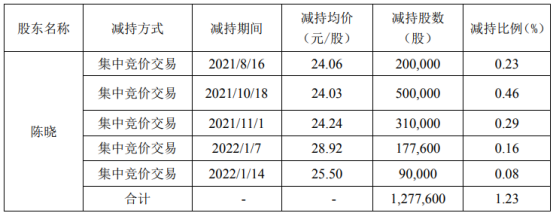
- 凤形股份股东陈晓减持127.76万股 价格区间为24.03-28.92元/股
- 中船应急股东七一九所减持1921.17万股 套现1.9亿元
- 国泰君安发行30亿元短期融资券 兑付日为2022年12月8日
- 抖音盒子,起步艰难
- 暴利的精酿啤酒,却长不出巨头
- 2021在线教育:收缩、溃败与转型
- 雪崩前,微软为何肯豪掷近700亿美金
- 钱大妈生鲜败走北京
- 这个赛道迎来倒闭潮:小米也没干好
- 潮流消费俘获Z世代
- TPG旗下诺威健康完成7.6亿美元新融资,估值30亿美元
- 互联网,不能失去投资的力量
- 字节战投部裁撤,创投圈再无巨头接盘侠?
- 字节跳动解散战略投资部,互联网大厂告别赢者通吃时代
- 15天搭建一条特色商业街,街景梦工厂完成近亿元A+轮融资
- 33岁「退休」的中国外卖教父,又准备大干一场
- 美妆新零售品牌「HARMAY話梅」完成近2亿美元C轮及D轮融资
- 「双减」后的首个寒假,什么变了
- 钱大妈加盟扩张存在模式缺陷
- 快递行业要变了
- 新「赌城」宁德,隔壁温州都要抄作业
- 中国人已经实现“牛排自由”了吗
- 600亿婚纱摄影市场,互联网的蛮荒地
- 咖啡下沉,蜜雪冰城跟瑞幸抢生意
- 那些新消费品牌决定去播客
- 葡萄酒2021:从效仿到去欧洲化,如何品出新口味
- 8成收入依赖肉干,北交所宠物食品第一股成色几何
- 山西长治市潞城区设立亿元规模人才创业基金
- 盲盒离「熄火」还远
- 微软收购动视暴雪,走不出的IP战争
- 东南亚物流战事:守望最后一公里的Ninja Van
- 被“小视”的锅圈正在提升新一代的做饭效率
- 又一上市公司参投产业基金,规模1.5亿
- 瑞幸,是不是精品咖啡的搅局者
- 创立十年,国药资本今天正式更名
- 央视再曝光,低价财商课为何成了打不死的小强
- 共享充电宝的2021:高光、震荡与新的变量
- 游戏史上最大收购,微软687亿美元收购动视暴雪,加码元宇宙
- 800刀七天MBA速成班,打工人的「逆袭班」
- 团车造车,王多鱼看了都说好
- 又一个外国巨头倒下了,在中国只剩回忆杀
- 7个月连获3轮,新锐护肤品牌「C咖」完成SIG领投B轮融资
- 首只“高校+政府+产业”基金启动投资 华德诚志重科技基金加...
- 扇贝游回獐子岛了 ?
- 9元喜茶,如何为600亿估值「造梦」
- 泉州交通发展产业母基金正式备案,规模百亿
- 獐子岛为何荒唐涨停
- 字节跳动大力布局文娱,短期内能变现吗
- “车企创始人骂街第一人”又开炮了
- 687亿美元惊天大收购:动视暴雪服软了
- 微软花687亿买下暴雪一具空壳
- 2021,爱奇艺无能为力
- 「柏全生物」宣布完成数千万天使轮融资,上海生物医药基金领投
- 运达科技2021年预计净利9695.47万-1.29亿元 同比下降超两成
- 赣能股份2021年预计亏损2.17亿-3.2亿元 同比由盈转亏
- 汇纳科技股东减持425.46万股 套现7190.22万元
- 海联金汇副总裁周建孚辞职 第三季度净利润为7739万元
- 开尔新材控股股东吴剑鸣质押2000万股 第三季度净利润为3432万元
- 首都在线控股股东曲宁质押1633万股 第三季度净利润为343万元





 营业执照公示信息
营业执照公示信息